北京大学的新突破!Nature发布了刘志博团队对靶向共价放射性药物的报道
近日,北京大学化学与分子工程学校应用化学系刘志博团队在《自然》杂志上发表了题为“Covalent Targeted Radioligands Potentiate Radionuclide Therapy”研究论文报道了一种颠覆性技术和优秀的核药设计领域的临床研究数据,有望重写相关疾病的临床诊断和治疗指南。基于现代共价药物分子工程,该工作开发了一种新型药物方法,即靶向共价放射性药物(Covalent Targeted Radioligand, CTR),该平台的技术有效性已经从分子、细胞、老鼠和病人中得到验证,突破了纤维细胞活性蛋白质(FAP,针对肿瘤摄入、停留不足等原因导致疗效不佳的靶向放射配体瓶颈(图1)。据悉,自1977年以来,Nature杂志首次发表了核素治疗相关工作。
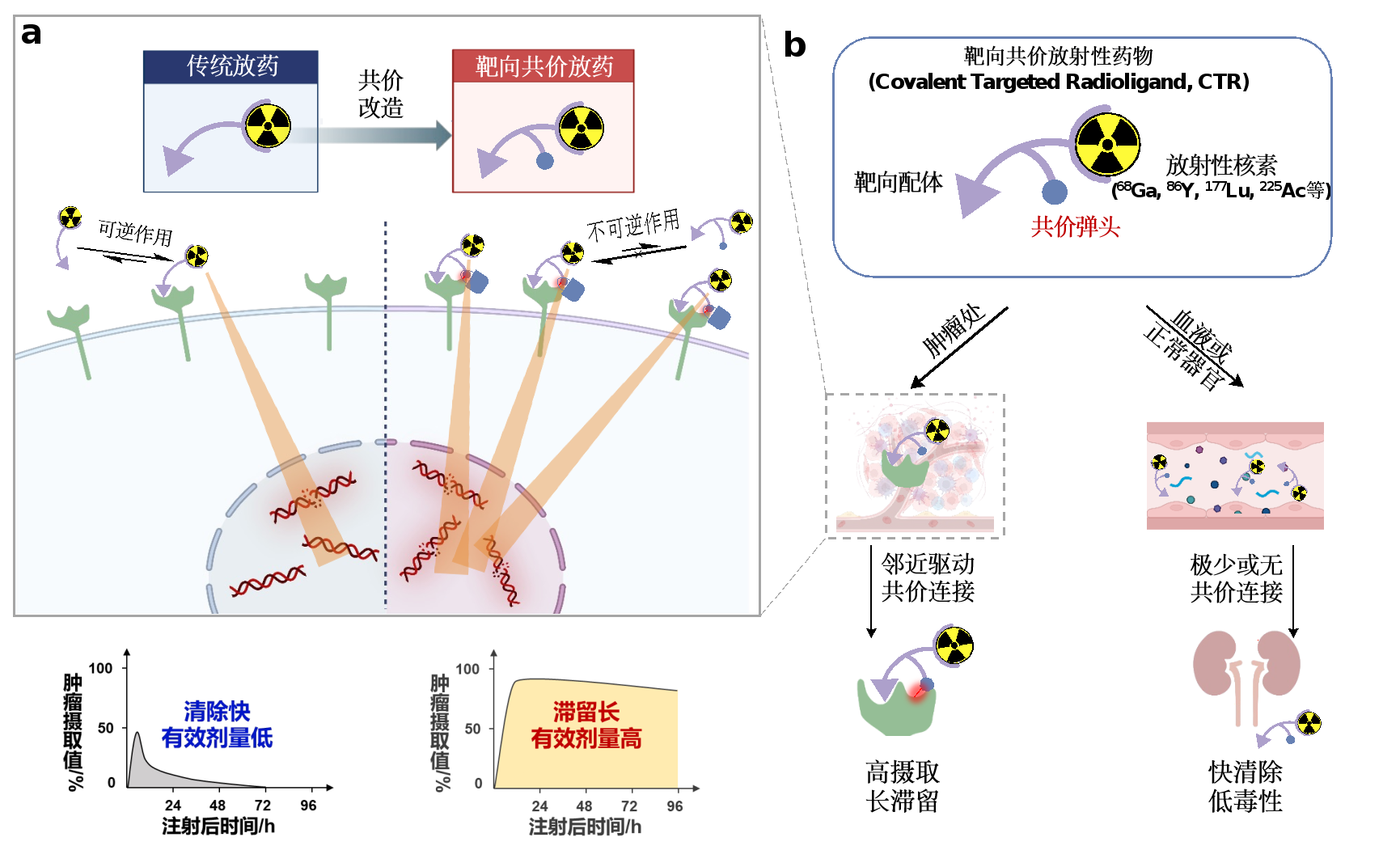
图1 靶向放射性药物的工作原理及其优点
如图1b所示,CTR在体内的工作模式。CTR可以是基于二代“点击化学”硫磺的三功能配体,在合适的位置和取向上设置。(Ⅵ)-氟交换反应(SuFEx)“潜弹头”(latent warhead),在不丧失亲和力的情况下,实现配体对靶蛋白的共价连接,同时将携带核素的螯合剂不可逆转地装饰在靶蛋白上。CTR到达肿瘤时,首先以非共价结合目标,然后通过相邻效应加速不可逆转的共价连接,在提高亲和力的同时最大限度地降低肿瘤的去除率。而且其它没有结合目标的自由CTR则被迅速排出体外。由于“潜弹头”的相对生物正交,CTR的脱靶共价连接有限,因此其系统毒性可以得到有效控制。值得一提的是,该研究首次报道了药代动力学研究,该研究在人体内含有SuFEx共价弹头分子,并验证了其在放射配体方面的匹配性。
1. CTR-FAPI不可逆转的选择性共价连接FAPP
CTR成功的关键因素之一是合理应用共价弹头。研究人员在小鼠肿瘤模型中的初步研究表明,虽然在现有放射配体FAPI-04上设置磺酰氟弹头可以增加肿瘤的摄入量,但由于弹头反应活性过高,存在稳定性问题。选择弹头后,研究人员选择放射自显影。(Autoradioluminography)发现氟代硫酸酯弹头的安装不仅可以在试管中获得超过80%的FAP共价结合,而且在6天内基本没有解离。此外,通过对二级质谱的分析,研究人员发现,CTR-FAPI分子的共价连接残基点主要是Y210和Y450,其共价结合构象的合理性和安全性通过分子动力学模拟得到验证。
一般对共价药物的担忧是难以预测的脱靶毒性。CTR对胞内蛋白质的脱靶作用可能不成问题,因为放射配体一般具有高亲水性,包括多电荷螯合剂,大多数放射配体对细胞膜的被动透水性有限。研究人员主要考察CTR-FAPI对FAP同源膜蛋白的选择,发现它仍然可以保持FAP选择性的104倍。另外,在小鼠血液和病人尿液中,CTR-FAPI还显示出极低的脱靶反应。
2. CTR-PET显像对比度更好的FAPI显示。
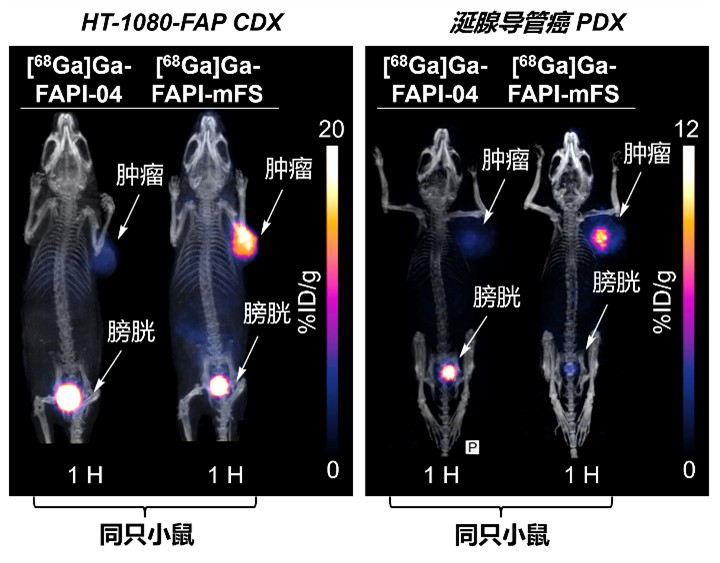
图2 在动物模型中,靶向共价放射性药物显示出较高的肿瘤摄入量。
基于一系列分子实验和细胞验证,研究人员将小鼠模型移植到FAP高表达的细胞来源中。(Cell-derived xenograft,CDX)小鼠模型与病人来源移植。(Patient-derived xenograft,PDX)进一步验证,Ga-68(t1/2=67 min)CTR标记-FAPI(即[68Ga]Ga-FAPI-mFS)显示肿瘤摄入量比原始FAPI高2倍以上,而健康组织摄入量迅速消除(图2)。与其他方法(包括传统FAPI)相比,在一项初步的肿瘤显像临床研究中-PET/CT)通过手术和病理研究,确定了更多的甲状腺髓样癌疾病为真阳性(图3)。与其他方法(包括传统FAPI)相比,在一项初步的肿瘤显像临床研究中-PET/CT)通过手术和病理研究,确定了更多的甲状腺髓样癌疾病为真阳性(图3)。上述结果表明,CTR-FAPI有可能成为下一代更高灵敏度的FAPI-PET探针。
图3 在癌症患者中,靶向共价放射性药物灵敏度高,可发现目前药物难以诊断的肿瘤疾病。
3. CTR通过提高停留来提高靶向放射性核素的治疗效果。
图4 [177Lu]CTR-FAPI可以完全抑制肿瘤的生长,延长小鼠的生存时间。a, 治疗方式;b, 肿瘤生长曲线;c, 生存曲线。
研究人员进一步选择Y-86(t1/2=14.7h)CTR-FAPI是正电子核素研究的一种长期药代动力学,发现肿瘤处摄取的积分以下(area under curve, AUC)增加约10倍。基于Lu-177(t1/2=6.7d)CTR-FAPI剂量计算也表明,肿瘤有效剂量增加了10倍左右。最终,研究人员分别采用β-(Lu-177)和α-放射性核素(Ac-225, t1/2=9.9d)标记CTR-FAPI,FAP高表达皮下肿瘤生长(图4)在后续治疗中几乎完全抑制了小鼠。另一种靶向前列腺特异性膜抗原(PSMA)SuFEx工程放射配体也显示出更强的治疗效果。由于可以连接SuFEx弹头的蛋白质范围很广,这种策略可能是针对其他靶点的放射性药物,为控制其他低含量偶联药物的药代动力学提供了新的途径。
刘志博教授是北京大学/昌平实验室的论文通讯作者。原北京大学化学与分子工程学校博雅博士后,昌平实验室崔希洋副研究员、作为论文的第一作者,北京大学肿瘤医院的主治医师、国家癌症中心/医科院肿瘤医院孔梓担任医生。研究成果得到了国家自然科学基金委员会、科技部、北京分子科学国家研究中心、北京大学-清华生命科学联合中心、昌平实验室、北京大学肿瘤医院等机构和项目的资助。该研究还得到了国家癌症中心/医科院肿瘤医院头颈外科主任刘绍严、北京大学肿瘤医院核医学科主任杨志、北京协和医院核医学科主任霍力、北京大学王初教授课题组、北京大学分析测试中心周文、刘霞先生、北京大学天然药物和仿生药物国家重室王倩先生的大力支持和协助。
论文链接:https://www.nature.com/articles/s41586-024-07461-6
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com





