中山大学发现“癌王”胰腺癌临床管理靶点及潜在药物
本文为转换医学网原创,转载请注明出处。
作者:Rainbow
简介:吉西他滨耐药是胰腺软管腺癌(PDAC)化疗效果的主要障碍。所以癌细胞对吉西他滨的敏感性需要新的策略。
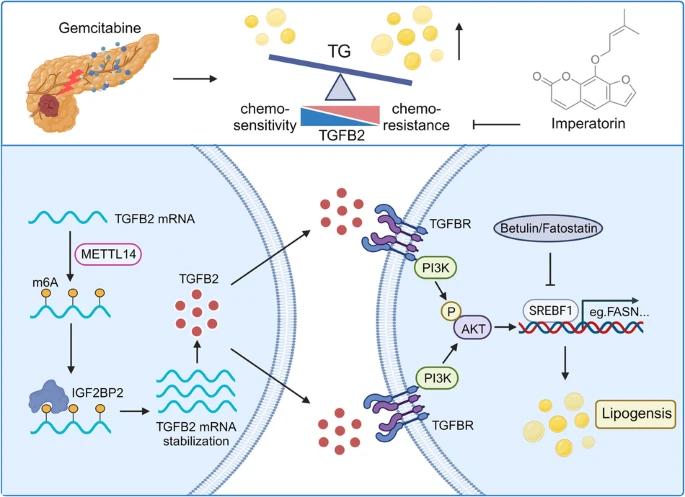
6月24日,期刊期刊中的中山大学研究团队《Oncogene》网上发表题为“N6”-methyladenosine modified TGFB2 triggers lipid metabolism reprogramming to confer pancreatic ductal adenocarcinoma gemcitabine resistance"研究论文,TGFB2触发脂质代谢重编程,首先证实N6-羟基腺苷修饰,赋予胰腺软管腺癌吉西他滨抗药性。吉西他滨耐药PDAC,TGFB2抑制剂欧前胡素和吉西他滨。 在PDX模型中有协同作用。吉西他滨耐药PDAC,TGFB2抑制剂欧前胡素和吉西他滨。 在PDX模型中有协同作用。结果表明,TGFB2和脂质代谢是PDAC临床管理的一个有前途的目标,而欧前胡素是一种潜在的药物,可以转化为临床试验。

https://www.nature.com/articles/s41388-024-03092-3
选题背景
01
胰腺软管腺癌(PDAC)它是一种极具侵袭性的癌症,其5年存活率为10%,近80%的患者表现为局部或远程转移的不可切除病。以吉西他滨为基础的联合化疗策略仍是晚期PDAC的主要治疗方案。PDAC患者对吉西他滨治疗的初始敏感程度非常普遍,但是抗药性的快速发展严重限制了这种治疗方法的疗效。所以,探索提高PDAC对吉西他滨敏感性的方法,并发现吉西他滨抗药性新靶点对PDAC的治疗尤为重要。
研究表明
02
研究表明,研究人员建立了吉西他滨耐药PDAC细胞,并使用RNA序列对其进行了分析。TGFB2被确定为吉西他滨耐药PDAC的关键基因,并与吉西他滨治疗反应不佳显著有关,因为它涉及到来自多个数据库的生物信息学分析。病人来源的异种移植物(PDX)该模型进一步验证了TGFB2在吉西他滨诱导抗药期间表达的逐步上升。TGFB2的沉默表达能提高吉西他滨对PDAC的化疗敏感度。
在机制方面,TGFB2通过METTL14介导的m6A装饰在转录后稳定,可以促进脂肪的积累,而强化甘油三酯的积累通过脂质组分析显示驱动吉西他滨的抗药性。通过PI3K-AKT信号,TGFB2转导上升脂肪产生调理剂甾醇调节元件结合因素1(SREBF1)及下游脂肪产生酶。另外,为了促进PDAC中吉西他滨的抗药性,SREBF1负责TGFB2介导的脂肪生成。在吉西他滨耐药PDACC中,TGFB2抑制剂欧前胡素联合吉西他滨 协同效应出现在PDX模型中。这项研究为缓解PDAC吉西他滨耐药性提供了新的思路,通过靶向TGFB2和脂质代谢,并开发了欧前胡素作为临床转化中具有前景的化学增敏剂的潜力。
研究结果
03
综上所述,研究首先证实了N6-羟基腺苷修饰的TGFB2触发脂质代谢重编程,赋予胰腺软管腺癌吉西他滨抗药性。吉西他滨耐药PDAC是TGFB2抑制剂欧前胡素和吉西他滨的结合。 在PDX模型中有协同作用。结果表明,TGFB2和脂质代谢是PDAC临床管理的一个有前途的目标,而欧前胡素是一种潜在的药物,可以转化为临床试验。
参考资料:
https://www.nature.com/articles/s41388-024-03092-3
阅读原文
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com





