沉重!全球首个TCR-T细胞疗法获批上市!肿瘤减少81%!
最近,巴黎奥运会隆重举行!中国队在金牌榜上名列前茅!当来自世界各地的运动员在荣誉与汗水交织的舞台上竞争时,肿瘤治疗领域也迎来了沉重的消息!
(美国时间)8月1日,首款工程化T细胞疗法可治疗实体瘤。(TCR-T)Afamitresgene 成功获得美国食品药品监督管理局的autoleucel(FDA)经批准,可治疗不可切除或转移性滑膜肉瘤成人病人,以前已经接受过化疗。

截图来自参考资料1。如有侵权,请联系我们删除。
这次许可主要是基于SPEARHEAD-1 (序列1)在44例滑膜肉瘤患者中,总缓解率为43%,中位缓解持续时间为44例,实验结果为43%。(DOR)至少有39%的病人减少了半年的持续时间。
SPEARHEAD-在I期临床试验中,TCR-T细胞疗法Afami-cel治疗6周后,有2例滑膜肉瘤患者实现了部分缓解。(PR),肿瘤病变各自减少45%和81%。
截图来自参考资料3。如有侵权,请联系我们删除。
T细胞受体工程化T细胞(TCR-T)治疗是一种隐性癌症治疗细胞免疫疗法,不受靶细胞表面抗原表达的限制。TCR-目前,T疗法在肝细胞癌、宫颈癌、胰腺癌、卵巢癌、肺癌等实体瘤领域取得了突破性成就。
TCR-TAEST16001细胞商品可减轻脂肪肉瘤患者超过1年!
七月三十日,国家医药产品管理局药品审评中心(CDE)将TCR-T细胞商品TAEST16001注射剂列入突破性治疗类别名单,这意味着TCR-T细胞治疗药物作为中国首个获准进行IND临床试验的TCR-T细胞治疗药物取得了重大突破,有望成为中国首款TCR-T细胞治疗药物。
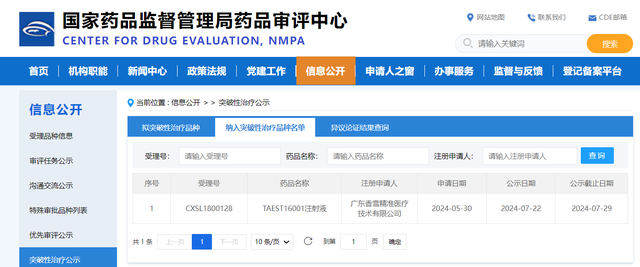
截图来源于国家医药产品管理局药品审评中心
美国临床肿瘤学会2022年(ASCO)发布TAEST16001治疗晚期软组织肉瘤病人I期临床试验的数据结果。本实验共入组12例晚期软组织肉瘤患者,其中滑膜肉瘤患者10例,脂肪肉瘤患者2例。数据显示:5例病人实现部分缓解(PR),5例病人病情稳定(SD),病症控制率(DCR)中位无进展生存期为83.3%。(PFS)中位缓解持续时间为7.2个月。(DOR)为14.1个月。
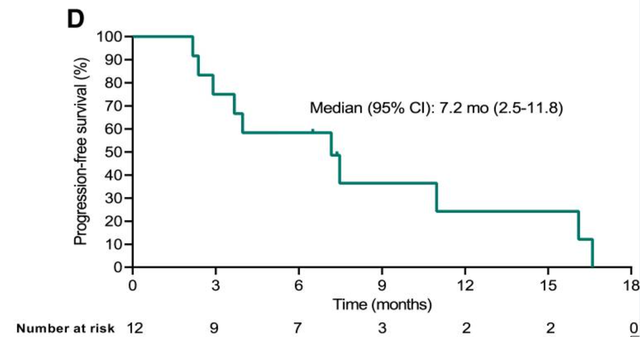
截图来自参考资料4。请联系我们删除侵权信息。
值得注意的是,在TCR-T细胞TAEST16001治疗后,1例脂肪肉瘤患者在TCR-T细胞TAEST16001治疗后得到了部分缓解,并持续减轻超过1年!
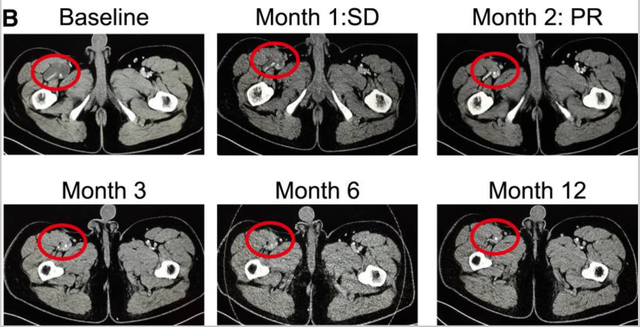
截图来自参考资料4。请联系我们删除侵权信息。
2024年美国临床肿瘤学会(ASCO)上,TCR-TAEST16001公布了晚期软组织肉瘤的治疗方法(STS)II期临床数据(NCT05549921)在里面。共有8例软组织肉瘤病人当选,数据显示:4例病人实现部分缓解。(PR),3例病人病情稳定(SD),客观缓解率(ORR)达到50%,这种缓解率远远超出预期效果!
TCR-治疗肝细胞癌T细胞疗法治疗肝细胞癌
在I期NCT03899415临床试验中,共有8例乙型肝炎病毒病毒。(HBV)肝细胞癌患者,中位总生存期(OS)33.1个月,接近3年!
治疗165天后,其中1例患者出现肿瘤坏死,425例。 后天,肿瘤明显减少。
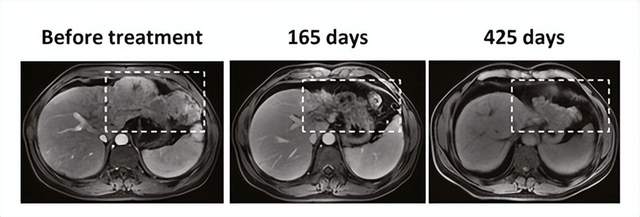
截图来自参考资料5。如有侵权,请联系我们删除。
TCR-T细胞疗法治疗HPV病毒有关上皮癌
国际顶级期刊2021年2月《Nature》发布了靶向 HPV-16 E7 关于上皮癌的临床试验(NCT02858310)数据,TCR-T细胞疗法治疗转移性人瘤病毒。12例患者中有一半实现了部分缓解。(PR)。
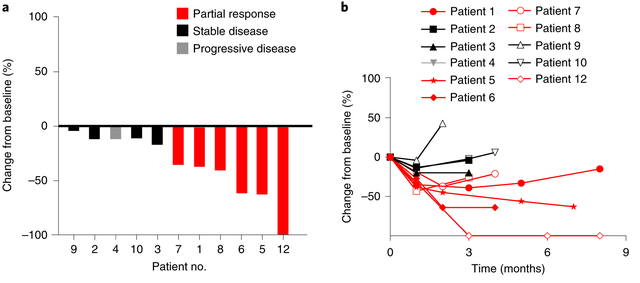
截图来自参考资料6。如有侵权,请联系我们删除。
结语
Afami-celTCR-T疗法成功获批,是TCR-T细胞疗法在实体瘤领域的重要里程碑!Afami-cel的批准肯定会激发国内企业的“战斗力”。相信更多的TCR-T细胞疗法产品会在不久的将来获批上市,让患者有更精准多样的治疗选择!
本文已被版方要求在健康界发表。
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com





