走出“技术沉没周期”的阿尔兹海默病
1906年,美国发明家德·福雷斯特创造了电子三极管,奠定了现代电子学的基石。然而,在人类克服了电子学的瓶颈之后,他们在医学领域遇到了新的“瓶颈”。
一位名叫阿洛伊斯·阿尔茨海默的医生在同年11月举行的第37届精神病学家会议上向世界报告了一种全新的精神疾病。在解剖了一个51岁的女性遗体后,他惊讶地发现患者的大脑中有大量深色淀粉样斑点。四年后,这种疾病被称为阿尔茨海默病(简称AD)。
在接下来的100年里,无数学者和制药公司在阿尔茨海默病药物的研发上投入了大量的时间和金钱,但只有一个又一个失败的案例。
据美国药品生产与R&D协会发布的研究报告显示,仅在2000-2017年间,全球共有6000多亿美元投入研发阿尔茨海默病药物,300多种临床药物失败,失败率高达99.6%,占所有药物研发失败率的首位。
突破阿尔茨海默病,不仅具有巨大的财富价值,而且已成为当今世界医学家渴望实现的梦想之一。
01 AD陷入了“技术沉没周期”
对AD的探索,就像盲人摸象一样,一直没有找到准确的方向。
认知度下降是AD的典型特征,但也是自然衰老的特征之一。两者最大的区别就是AD会加快认知度下降的速度。即便如此,这种认知度下降也是一个非常漫长的过程。很有可能近二十年,这么长的时间跨度让人类很难突破AD。
图片:老化和阿尔兹海默病,来源:西部证券
虽然人类已经与AD抗争了一百年,但他们始终没有准确找到其发病机制,一切仍然是一个可疑的群体。为了接近真相,科学家们提出了各种假设来验证,比如Aβ级联假说,Tau蛋白异常磷酸化假说,胆碱能假说。
但是遗憾的是,到目前为止,还没有一种假设得到了业界的认可,这就是为什么人类在AD领域没有任何收获。
◆Aβ级联假说
AD的主要病理特征之一是淀粉样斑块,它是由AD引起的。β沉积物的形成,自然也被认为是人类攻克AD的突破之一。Aβ目前,级联假设已成为AD药物研发的主流路径。
这样的假设感觉,在正常的生理环境中,Aβ在病理学的前提下,形成和清除处于稳定平衡的过程中,Aβ产生增加或清除减少,导致平衡被打破。Aβ过多地附着在大脑中,从而导致一系列的病理过程,这些病理过程反过来又使Aβ增加,构成级联放大效应。
图:Aβ级联假设示意图
基于此,一些科学家提出了选择性结合和消除Aβ为了在AD中扭转神经退行过程,淀粉样蛋白聚集体的方法。
◆假设Tau蛋白异常磷酸化假说
AD患者的病理特征不仅仅是淀粉样斑块,神经元纤维缠结也是神经原纤维异常聚集形成的主要病理特征之一,其主要成分是高度磷酸化的Tau蛋白。
图片:Tau蛋白过度磷酸化假说示意图,来源:中国银河证券
当Tau蛋白高度磷酸化时,它可以从微管中分离出来,失去对微管的稳定性,导致物质运输损伤和神经纤维衰退,从而导致AD疾病。
◆胆碱能假说
关于AD发病机制,胆碱可假说是最早的一种理论。
乙酰胆碱与人的认知和记忆密切相关,而AD患者脑中胆碱能神经元严重缺失,中枢胆碱能递质不足,导致定向力障碍、记忆力减退、行为和性格变化。
现在已经上市的AD药物,大部分都是根据胆碱可假设开发的,但是很明显,它们还没有完全解决人类在AD上的问题。
诱因成谜,病程进展时间长,临床指标差异大,诊断难度大,AD新药研究长期陷入“技术沉没周期”。
02 药企“黑洞研发”
回顾药企AD的研发历程,堪称人类药物研发失败的历史。
强生/辉瑞的单抗药BapineuzumabII期临床试验在2012年失败;
罗氏在2014年宣布GantenerumabII期临床试验失败;
礼来宣布,2016年II期临床药物Solanezumab尚未达到主要临床终点;
2017年,默沙东宣布停止开发BACE抑制剂药品Verubecestatata。;
强生宣布将于2018年终止BACE抑制剂Atabecestatata。 II临床试验/III期…
无数药企投入巨资却跌跌撞撞,不禁让人生出绝望的挫败感。
FDA在2021年之前只允许6种药物治疗AD,包括:他克林。(Tacrine)、多奈哌齐(Donepezil)、卡巴拉汀(Revastigmine)、加兰他敏(Galantamine)、美金刚(Menantine)还有美金刚/多奈哌齐复方制剂。
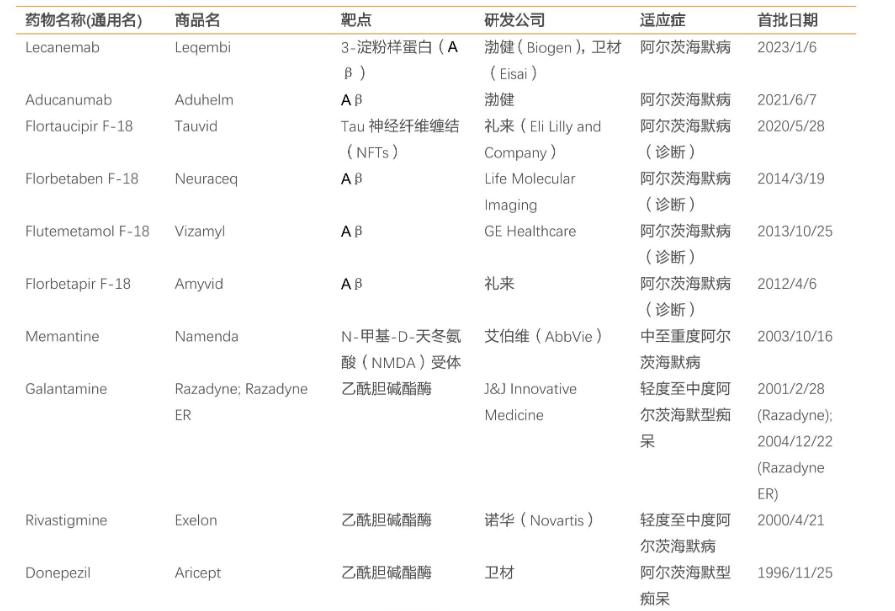
图片:部分AD药品获批上市,来源:TF证券
其中,前四种是以胆碱能假设为主的乙酰胆碱酶酶。(AchE)抑制剂;美金刚是N-羟基-D-天冬氨酸(NMDA)受体拮抗剂,但是这些药物只能改善病人的症状,不能缓解AD的临床表现,也不能逆转或减缓疾病的发展。
与此同时,目前获批的AchE抑制剂也有不同程度的副作用。他克林于1993年获批,会损伤线粒体,抑制DNA合成蛋白质,诱发细胞坏死,引起严重的不良反应。临床症状主要是肝毒性和胃肠道反应,最终别无选择,只能退出市场。多奈哌齐是中国使用最多的AD药物,其严重的不良反应包括神经紊乱(如躁狂、攻击和暴力等)。).
2019年,绿谷制药甘露特钠胶囊在国内获批上市,可治疗轻度至中度AD,改善患者认知功能。它是中国第一种治疗AD的原创药物。其作用机制是重塑肠道菌群,抑制肠道细菌氨基酸神经炎症,从而抑制AD。
但自上市以来,该药一直备受争议,主要问题指向其。Ⅲ临床试验周期短,效果评价不充分,药物作用机制解释不清,疗效曲线突变怪异。因此,即使进入医疗保险后价格大幅下降,销量也远不如想象中的理想。
根据Worldd的说法,随着全球人口老龄化的加剧,AD患者的数量不断增加。 Alzheimer 根据Report数据,2015年AD患者人数为4680万,预计2030年将达到7470万,到2050年,这一数字将达到1.3亿。
“无药可治”的困境使AD成为世界上隐藏机会最大的药物类别,也有望成为继心血管疾病、脑血管疾病和癌症之后的世界第四大药物市场。
03 百炼终成钢
人类最终在2021年取得了新的突破,因为传统疗法迟迟不能满足AD用药的需要。
FDA允许渤健的Aduhelm于2021年6月上市,这是第一款基于Aduhelm的产品。βAduhelm选择性识别Aduhelm选择性识别Aduhelm,也是第一种治疗AD本身的药物。β免疫球蛋白G1(IgG1)单克隆抗体,以及病人大脑中的Aβ结合沉积,激活免疫系统,清除大脑中的沉积蛋白,从而影响AD的发病过程。
根据临床数据,渤健向世界证实,Aduhelm可以显著减少患者的淀粉样斑块,这也是它获得FDA批准的原因。然而,这种淀粉斑点是否是阿尔茨海默病的致病因素仍然存在争议,而Aduhelm并没有向市场证明这一点,Aduhelm仍然存在明显的副作用,这也是它最终商业化失败的原因。
然而,Aduhelm的失败并没有让渤健放弃AD药物的研发,基于Aduhelm的失败经验,两年后渤健又一次带着另一款产品Leqembi回到了大众的视野,让人们再一次看到了突破AD的曙光。
FDA于2023年1月宣布,完全批准了仑卡奈单抗抗性药物,由卫生材料和渤健联合开发。(Leqembi),可治疗早期AD病人的上市,成为世界上第一种可减缓AD进程的药物。该药品于2024年1月在中国获准。
III期临床研究结果表明,与安慰剂相比,Leqembi治疗组病人CDR-SB(各种严重程度的量化痴呆症)减少了27%。在意向医治(ITT)在人群分析中,评分差别为-0.451。(p=0.00005)。就安全性而言,Leqembi显著降低了脑肿胀的发生率,只有13%的患者接受了Leqembi治疗。由于其良好的安全数据,上市后没有添加“黑框警告”。
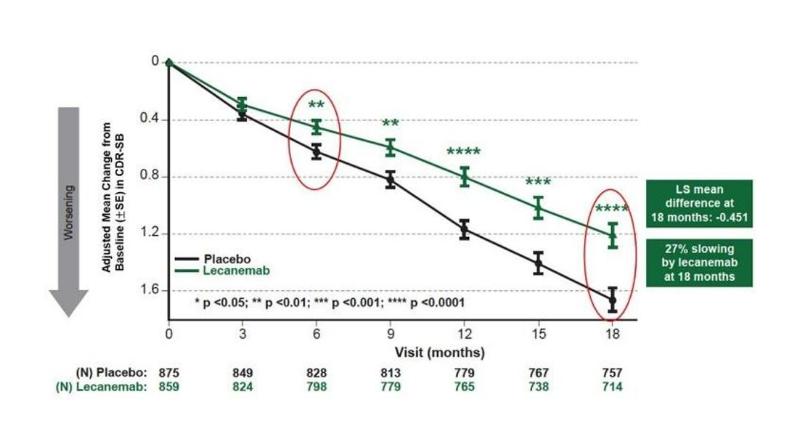
图片:Leqembi已经到达主要的临床终点,来源:卫生材料公告
A初步验证了Leqembi的成功批准β假设有效性,是AD领域药物开发的标志性事件,被称为AD治疗的新开始。
在Leqembi上市半年后,礼来还在AD领域取得了突破,披露了AD药物Donanemab的最新完整三期临床数据。接受Donanemab治疗的受试者进展到下一阶段的风险比安慰剂降低了39%;52%的受试者在一年内达到清除淀粉样蛋白斑的要求,72% 受试者在18个月内完成。
根据临床研究数据,Donanemab的疗效比Leqembi要好,礼来也提交了上市申请。但是,这并没有帮助Donanemab顺利上市,FDA最终决定在今年3月推迟Donanemab药品的上市许可,并组织外部专家会议讨论药品的安全性和有效性。
04 ADR&D终于亮了
在AD治疗领域,Leqembi的成功打开了新世界的大门,成为AD药物研发的新途径。
下一步,各大药企可能会沿着这条路径进行疗效与安全的较量。
在AD治疗领域,除Leqembi和Donanemab外,还有127种潜在药物正在进行164项临床试验。其中,III期临床试验共48项,包括32种药物;II期临床试验共90项,包括81种药物;I期临床试验共26项,包括25种药物。
基于Aβ假设疗法是资金和研究投入最多的类型,进入临床开发的产品也是礼来的Remternetug。、Annovis Bio的buntanetap、iclepertinn勃林格殷格翰、阿斯利康/ Cerveau Technologies等。
图: AD研究药品的进展状况
除靶向Aβ此外,许多其他R&D路线也在不断进步,包括GLP-1药品司美格鲁肽,在糖尿病和减肥领域大放异彩。AD适应症的研发正处于III期临床阶段。
对AD来说,越早发现,越早治疗,就越容易减缓病程。但是,目前还没有针对AD的早期筛查产品上市。
基于这一背景,许多制药公司选择绕过早期发现阶段,直接开发AD疫苗,希望通过自身免疫清除AD。β淀粉样蛋白质或Tau 蛋白质,为阿尔茨海默病的治疗开辟了另一条道路。这其中,AC 2023年6月,由Immune和强生联合开发的AD疫苗ACI-24.060获得FDA授予的突破性治疗资格,目前正在进行II期临床试验。
AD领域再次点燃星火燎原,预计将点燃AD跑道长期被抑制的火焰。随着越来越多的资本进入,人类可能会开始全力以赴地在AD跑道上奔跑。
*本文以公开资料为基础,仅用于信息交流,不构成任何投资建议。
本文来自微信微信官方账号“医曜”(ID:yiyao-作者:青橡,36氪经授权发布,jinduan006)。
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com





