AI能否再造「司美格鲁肽」?百亿美金押注AI制药
AI制药终于迎来了临界点。
今年中国创新药出海交易十分火热,其中,AI制药公司成为了一股不可忽视的力量。在2025年3月至8月期间,元思生肽、华深智药、晶泰科技等公司接连完成了总金额达数十亿美金的BD交易。
元思、华深成立仅仅四五年时间,就在跨国药企严格的BD挑选中取得了成绩,这正是因为它们通过AI改写了大分子药物研发范式,提高了研发成功率。这些交易也让资本市场重拾信心,时隔三四年,数家AI制药公司近期再次获得了融资。
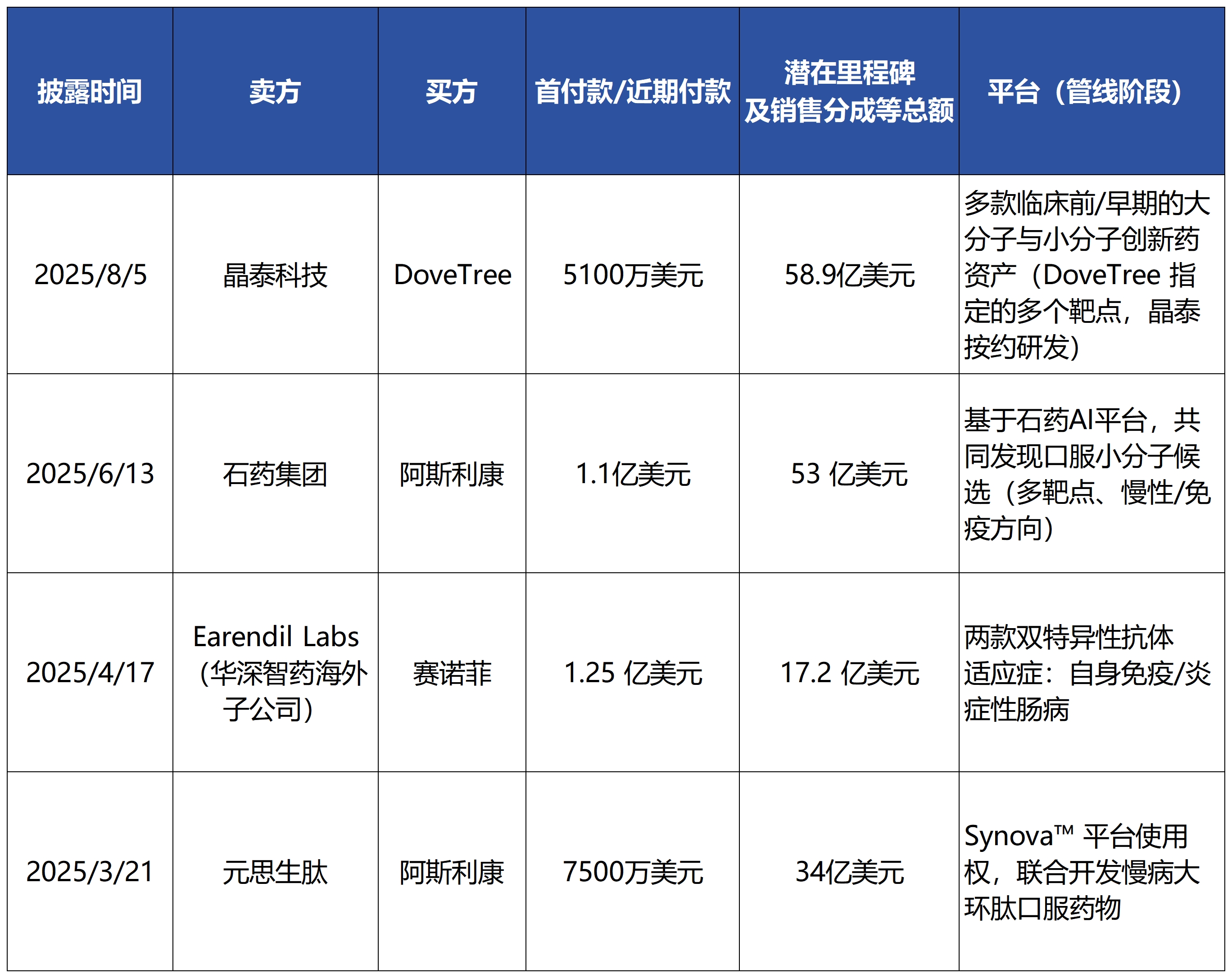
2025年部分AI制药公司BD交易
生物医药的底层研发范式,正从以往的海量筛选、经验至上,转变为理性设计、从头创造。
如果说上一个十年,能让早期药物发现更快、更准的AI,只是“锦上添花”;那么如今具备“从头设计”(de novo design)药物能力的AI,则可谓是“无中生有”。而设计出自然界中不存在的蛋白质、针对难成药靶点进行药物设计,正是攻克顽疾的关键。
最近,智源深澜创始人王承志在看到Chai Discovery(openAI投资)、字节跳动等发布的蛋白质设计生成模型数据后,认为“质的飞跃”即将到来。他在生命科学领域从业二十多年,曾任镁伽科技首席科学家,“要是在去年,我不会做出这样的判断;但今年AI的能力,让我意识到生物医药领域可能很快会有颠覆性事件发生,快到让大家来不及做好思想准备。”
峰瑞资本合伙人马睿也有相似的判断,“现在的趋势是‘创新药乘以AI’,虽然业内对AI制药的能力边界还没有定论,但我感觉已经是暗流涌动,未来一到三年应该会有巨大的变化。”上一波浪潮中,他所在的机构A轮领投晶泰科技、天使轮领投剂泰医药,获得了巨额回报,退出晶泰科技的现金回报倍数(DPI)可达几十倍。
那么,生成式AI究竟是如何改写新药研发底层逻辑的,可能会对创新药产业带来哪些改变,当前从业者们正通过哪些路径迈向“颠覆式创新”呢?
AI让制药从“大海捞针”变为“精准设计”
“AI制药”的发展并非一帆风顺,也曾经历过泡沫。在2018 - 2021年间,以小分子药物开发为代表的AI热潮,吸引了几百亿资金,却未能实现最初的愿景。当时,在深度学习和虚拟筛选的路径下,AI虽然可以加速早期药物发现进程,但筛选出的分子在效力上难以超越现有药物,或者生成的全新分子结构难以合成。这本质上是早期模型“归纳能力”的局限。
新一波的AI浪潮,是主流AGI技术取得重大进步后,其能力延伸至药物研发、酶设计等生命科学领域。
首先是AlphaFold 2的出现,它证明了Transformer架构在理解“生命语言”方面同样有效,解决了困扰生物学界多年的蛋白质折叠问题。在AF2出现之前的60年,人类大约了解了20万个蛋白质的结构,但AF2出现后的两年间,AI已预测了超过2亿个蛋白质的结构,几乎涵盖了地球上所有已知生命体的多数蛋白质,且结果高度可信。
其次,David Baker团队将图像生成领域的Diffusion(扩散)模型引入生物学,利用“迭代去噪”原理,使全新蛋白质设计的成功率有了大幅提升。
同时,AlphaFold 3从只能预测单个蛋白质结构,发展到能够处理蛋白质、核酸和小分子之间复杂的相互作用。这种“全原子级”的建模方式,让它在数据不足的情况下,具有更强的泛化能力。
目前,国内外有多个团队正在复现并提升AF3的模型预测能力。今年年中,Chai Discovery发布的Chai - 2、Evolutionary Scale发布的ESM3、字节跳动公布的Protenix等新模型的出现,证明了“从头开始,生成全新功能分子”的创造力。
“Chai - 2最新公布的数据显示,针对特定靶点,其生成的候选抗体,命中率显著高于传统方法。过去,要在百万级到亿级的库里,才能筛选出几个阳性分子,现在几十条序列里就可能出现有效分子。这在以前是不敢想象的。”王承志告诉36氪,这意味着,“指定靶点表位,生成抗体”的难题,即将被解决。
传统的抗体药物研发,从确定靶点、免疫动物到筛选出有高亲和力的有效抗体,是一个漫长的“大海捞针”过程。过去可能要花费3年时间、500万美元才能解决的抗体分子发现问题,Chai - 2等AI模型可以在几小时内完成,并在两周内通过生物湿实验得到验证。
马睿也表达了类似的观点,他认为Chai Discovery可能会颠覆抗体药的研发范式,此前的杂交瘤技术、噬菌体展示及动物免疫等方法,可能会被从头(de novo)计算设计大量取代。如果AI在小分子设计上也能取得突破性进展,那“几乎所有药物类型都可能被AI赋能。”他直言:一切发展得太快了,真正意识到这一趋势的人还不多。
届时,药化学家在针对某个靶点设计抗体药时,可能首先会使用AI模型进行计算、生成、打分,挑选出最有潜力的几十个抗体序列,然后合成并进行体外实验验证。
这种药物研发范式的改变,将对创新药产业链产生深远影响。
如今,创新药领域容易开发的项目已被挖掘殆尽,那些因缺乏苗头化合物而无法推进的“难成药”靶点研发,有望借助AI重新启动。从过去的“有什么筛什么”,到AI时代的“要什么造什么”,人类有可能攻克一些无药可治的顽疾,一些副作用大的药物,也可能被更好的分子所取代。
王承志认为,AI将大幅缩短临床前药物研发的周期,对肿瘤、自免、代谢等领域的适应症都有积极影响。其中,最早受益的可能是“慢性病”,未来像司美格鲁肽这样百年一遇的“神药”,出现的频率会大大增加。相反,由于AI等计算工具的普及,传统的、依赖大规模动物模型的药物筛选平台,其商业价值会受到一定冲击。
未来,具有AI能力的biotech公司将成为跨国药企的“分子设计中心”、“算力中心”,负责前端高技术含量、高频次的药物发现;跨国药企则主要负责后期临床试验、注册准入和商业化。双方将通过管线BD授权、合作研发等模式,共享利益。
资金有限,优先做什么?
每次技术革命都会引发行业洗牌,各方都在预测和选择最有潜力的参与者。在临界点即将到来之际,通往未来的道路不止一条。如今,AI制药领域的参与者大致呈现出三种类型。
第一类是拥有充足资本和算力的科技巨头,如Google(Deepmind)、Meta、Xaira(种子轮融资10亿美元)、字节跳动等。它们致力于构建基础生物大模型,创建自己的开源生态,定义行业标准。
第二类是由顶尖AI大模型和生物计算科学家领衔的创业团队,他们有能力在算法的“无人区”进行探索。在对基础模型进行优化改造后,为药企、生物科技公司提供平台服务,或者开展自研管线。典型代表有百图生科、华深智药、英汐智能、分子之心、百奥几何等。
第三类是利用AI研发新药的“传统正规军”。他们不追求自研新的基础模型,而是根据自身对适应症、靶点、管线竞争的了解,利用AI开源模型和强大的湿实验能力,加速特定疾病药物的研发进程。
在马睿看来,评估AI制药赛道玩家的核心竞争力,在于其对模型的理解、修改和演进能力。从很多人利用AF3等开源模型进行基准测试的结果来看,依赖微调的开源模型或许能达到“80分”,但要解决实际研发中的复杂问题,往往需要接近“99分”的表现,只有在算法层面做到极致,才可能实现跨越式发展。
另一位生命科学领域专家指出,绝大多数公司无法承担自研基础生物模型的高昂成本,与大语言模型相比,生物模型所需的数据获取成本更高。他提到,国内曾有一家得到巨头支持的企业,投入数千万元,合成并测试了上万条AI生成的抗体序列,并将实验数据集用于模型训练。但最终发现,这样的数据规模,仍远远不足以进入scaling law所描述的高效提升区间。
王承志也有类似观点,他认为未来能够快速、大量产出高质量生物实验数据的团队,更有可能拥有高性能AI模型。”过去,自动化、高通量实验通常被认为是提高筛选效率的手段。但在AI时代,它们不仅能为研发人员提供实验结果,还能高效产生结构化、可迭代的数据,直接用于模型训练和优化。
算法和数据都是提升AI制药能力的核心要素。尽管各家创始人背景和团队优势不同,短期内资源投入的重点会有所差异,但AI在制药领域的产业化路径越来越清晰。即研发出真正有价值的药物分子,并在现有的BD体系中,获得买方认可,拿到实际资金。
“按照当前的趋势,未来所有新药研发公司都会使用AI,只是依赖程度不同;对AI制药公司来说,只强调模型也不行,最终还是要交付药物分子,才能获得更高的价值。”马睿总结道,“所以我最近一直在说:创新药就是AI制药,AI制药就是创新药。”
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com





