武大学霸创出一家IPO,泰格、贝达、金斯瑞押注
今年以来,双抗无疑是国产创新药领域最靓的仔。
在9月的WCLC大会上,康方生物凭借PD-1/VEGF双抗积极的III期临床研究结果,击败了默沙东的K药,赢得资本市场的大力追捧,康方生物的股价自5月24日的低点至今涨幅达142%,成为创新药行业的佼佼者。
就在11月中旬,海外大药企先后看上国内橙帆医药、康诺亚-B、礼新医药、普米斯生物4家生物医药公司,而且看中的都是各家公司的双抗新药,让国产双抗赛道再次火了一把。
近期,又有一家双抗药物研发企业递表港交所。
11月24日,港交所网站显示,翰思艾泰生物医药科技(武汉)股份有限公司-B(下称“翰思艾泰”)递表港交所,保荐人为工银国际。
武大学霸创业,产业基金加持
翰思艾泰成立于2014年12月19日,总部位于武汉,是一家拥有结构生物学、转化医学及临床开发方面自主专业技术及经验的创新生物科技公司,致力开发新一代免疫疗法,最终帮助世界各地的患者。
张发明博士是公司的董事长兼执行董事,今年60岁,他本硕毕业于武汉大学,后获得中国科学院生物物理研究所生物化学博士学位,并于2003年8月获得印第安纳大学凯利商学院工商管理硕士学位。
张博士在医药及生物技术行业拥有超过30年的丰富研发经验,曾在得克萨斯大学西南医学中心、礼来制药、印第安纳大学、武汉大学任职或任教多年。除翰思艾泰外,他还参与创办了中美冠科生物技术(北京)有限公司、中美华世通生物医药科技公司。
翰思艾泰成立至今,一共进行了3轮融资,吸引了包括泰格医药、北京龙磐、贝达药业、金斯瑞生物科技旗下基金等知名机构的投资;招股书显示,2024年6月,翰思艾泰最后一轮融资的投后估值达16.15亿元。

公司融资历程,来源:招股书
翰思艾泰致力于发现、研发及商业化用于癌症及自身免疫疾病精准治疗的同类首创及╱或同类最佳产品,以解决全球未获满足的医疗需求。
自2016年起,公司一直打造创新管线,已开发由共10种候选药物组成的管线,包括核心产品HX009及两种主要产品HX044及HX301,其中有八种针对肿瘤学的候选药物及两种针对自身免疫疾病的候选药物。
除HX301乃自Onconova Therapeutics, Inc.授权引进外,其余管线候选产品全部为自主研发。
公司在研产品和行业情况
截至最后实际可行日期,公司的核心产品以及主要产品正在中国及澳大利亚进行临床试验。下图为截至最后实际可行日期公司的管线产品及于往绩记录期间之前已转让的商业化产品的开发状态。

公司主要在研产品,来源招股书
核心产品-HX009
翰思艾泰的核心产品HX009是一种自主研发的PD-1/SIRPα双功能抗体融合蛋白。于往绩记录期间及直至最后实际可行日期,已在澳大利亚及中国完成HX009的I期临床试验;目前正在中国开展两项HX009临床计划,即HX009-I-01中国研究(Ib期),用于治疗晚期黑色素瘤,以及HX009-II-02中国研究(I/II期),用于治疗R/R EBV+非霍奇金淋巴瘤。
主要产品-HX301
HX301是一种多靶点激酶抑制剂,具有独特激酶抑制特性,体现出癌症治疗的重大进步。作为在研多激酶抑制剂,HX301的作用机制是通过靶向CSF1R、ARK5、FLT-3及CDK4/6等关键通路对抗各种癌症。
目前公司已完成HX301的I期临床研究,并计划开展HX301与替莫唑胺联用治疗脑胶质母细胞瘤的II期临床研究。
主要产品-HX044
HX044是一种双功能抗CTLA-4抗体╱SIRPα融合蛋白,可用于治疗多种晚期实体瘤恶性肿瘤的创新型临床阶段药物,尤其是治疗PD-1耐药实体瘤(包括但不限于非小细胞肺癌、黑色素瘤、肾细胞癌及胃肠癌)。
截至最后实际可行日期,公司正在澳大利亚启动用于治疗晚期实体瘤恶性肿瘤的I/IIa期临床研究,并取得国家药监局就其在中国的临床研究的受理通知。
此外,翰思艾泰还拥有7项临床前阶段的候选药物,涵盖抗体偶联药物(ADC)、双特异性抗体(BsAb)和单克隆抗体(mAb)。这些药物的研发将进一步丰富公司的产品管线,增强其在肿瘤和自身免疫疾病领域的竞争力。
受生活习惯、环境改变、筛查方式的进步等多种因素影响,肿瘤发病率不断提高,相关治疗药物的市场空间较大。根据弗若斯特沙利文报告,中国肿瘤免疫疗法的市场规模由2019年的11亿美元增长至2023年的35亿美元,预计将于2027年及2031年分别增至142亿美元及415亿美元,即2023年至2027年的复合年增长率为42.0%及2027年至2031年的复合年增长率为30.8%。
此外,全球肿瘤免疫疗法市场占全球肿瘤药物市场的比例由2019年的20.2%大幅增加至2023年的26.5%。预计2031年全球肿瘤免疫疗法市场将占全球肿瘤药物市场份额的50.6%。
不过,值得注意的是,公司所在的PD-1赛道面临的竞争格局并不乐观。截至目前,国内获批上市的PD1/PDL1已经接近20种。即便是研发难度更大的双抗赛道,在研管线数量也不少。根据弗若斯特沙利文数据,除了HX009之外,目前国内还有7款PD-1/CD47及PD-L1/CD47双特异性抗体/双功能融合蛋白管线正在开展研究,全球其他地区另有4款同类产品正在开展研究。
无论如何,后期需要重点关注的还是公司在研药物的临床数据。
目前尚无产品在售,急需上市补充资金
值得注意的是,翰思艾泰曾将一款产品对外授权给了乐普,即HX008,这是一种与人类IgG4同型的人源化PD-1单克隆抗体。HX008已于2022年获批有条件上市,用于治疗微卫星高度不稳定╱错配修复缺陷的实体瘤及无法手术治疗或转移性黑色素瘤。
得益于HX008的成功商业化,截至最后实际可行日期,公司收到2022年及2023年的HX008年度特许权使用费分别约70万元及440万元。
财务数据方面,除于往绩记录期间前已转让予乐普的HX008外,公司目前尚无获批准商业销售的产品,因此报告期内无产品销售收入,并录得经营亏损。
2022年、2023年以及2024年1-6月,公司的全面亏损总额分别为2511万元、8462万元、4313万元,亏损主要来自研发成本及行政开支;其中,研发成本达到5868万元、4666万元、4203万元。
截至2024年6月30日,翰思艾泰账上现金为1.5亿元,如果仅考虑研发相关的支出,现有资金大概可以支撑未来2-3年的研发活动。
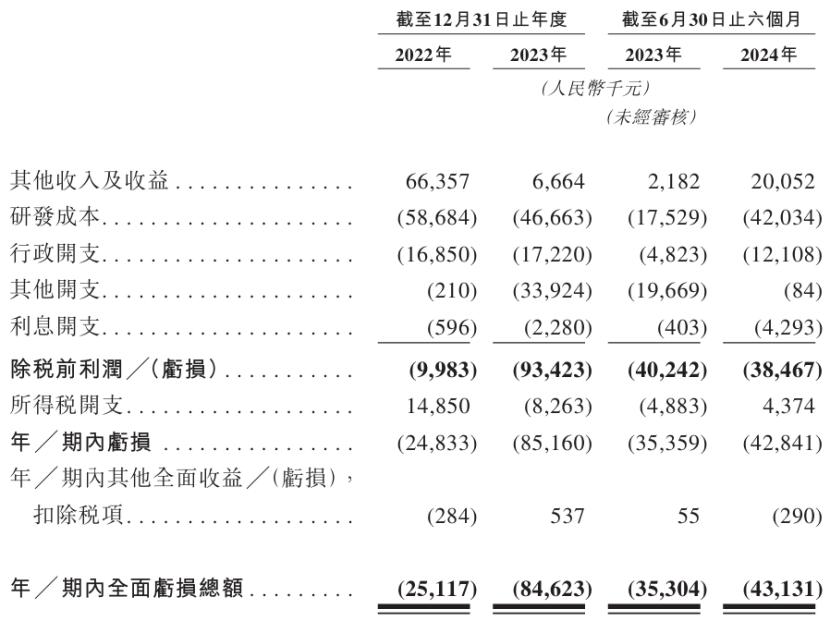
公司主要财务数据,来源:招股书
翰思艾泰表示,此次港股上市计划将募资金额用于核心产品HX009的研发,主要产品HX301及HX044的研发,其他重要产品的研发以及为商业化及业务发展活动提供资金等。
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com




